钛及钛合金材料在核工业、化工石化、航空航天、体育用品、牙科和医疗修复等领域得到广泛的应用[1-2]。钛合金材料也被认为是替代或修复失效硬组织(结构生物医学应用)的最佳选择材料[3]。由于表面形成氧化层而产生优异的耐腐蚀性以及较低的弹性模量, 钛合金比任何其他医学应用材料, 如不锈钢、工业纯(CP)Nb、Cr-Co 合金及CP-Ta 等更能满足性能要求[4]。医用钛合金的发展历程如图1 所示。
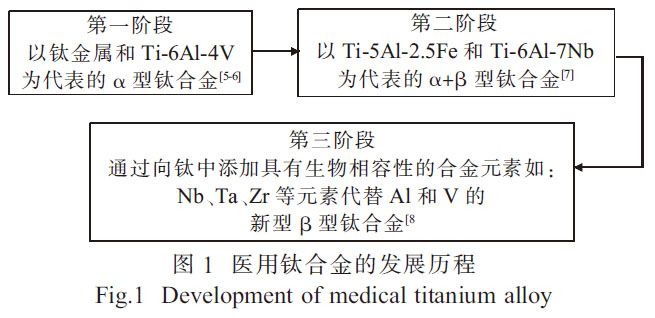
纯钛金属抗腐蚀性能较好, 但其生物相容性与综合力学性能较差, 强度相对较低且生产成本较为昂贵,因此钛合金成为良好的替代品[8]。Ti-6Al-4V合金一直是医用钛合金的主要成分,然而,对于永久性植入应用, 该合金因释放钒和铝而产生的毒性效应限制了其在医学上的应用[9]。因此,新型医用钛合金在Ti-6Al-4V 合金的基础上, 引入了无钒和无铝合金作为医疗应用。为降低生产成本和提高使用性能,医用钛合金的制备工艺也成为了研究的重点。
1 、粉末冶金
粉末冶金(PM)法[10-11]具有接近最终金属成形的性能, 一直被推荐作为生产低成本钛合金零件的有效方法[12],其方法流程[13]如下,①首先制备合金粉末;②将粉末元素进行混合;③室温将混合粉末进行模压; ④在可控气氛炉中烧结以在粉末元素之间建立结合;⑤进行后期处理。合金与降低制造成本的最大化来自于所选的起始原料、合金元素和用于生产合金的加工步骤的组合。
整体形成β 相结构是有效降低钛合金弹性模量的途径,因此,可加入无毒β 稳定元素。Li等[14]以球形钛粉、非球形铌粉、非球形锆粉和近球形锡粉为原料,采用粉末冶金法将几种粉末经过混合、冷压以及烧结,成功制备了Ti-24Nb-4Zr-8Sn(wt%)合金,其极限拉伸强度为760MPa,弹性模量为56.9GPa,断裂应变为15.3%, 提高了该合金在生物医学中所需的力学性能。在骨科临床医学应用中,提高植入物的生物相容性以及与人体骨骼的融合能力是必要的。Xu等[15]首先利用连续惰性气体雾化法制备Ti35.4Zr28Nb 粉体,采用粉末冶金法制备了新型多孔Ti35Zr28Nb 支架材料,具有(132.5±3.5)MPa 的压缩屈服强度以及(2.9±0.4)GPa 的弹性模量等优异的力学性能,可作为理想的骨植入材料。在制粉过程中对雾化技术的改进,提高粉末压缩性和均匀性还有待提高。
在钛环、钛丝等钛合金研发中含有更多的普通低成本、低熔点元素越来越受到重视, 降低了昂贵稀有金属的含量从而降低了生产成本。Ehtemamhaghighi等[16]采用Ti 粉、Mn粉、Nb 粉为原料,将粉末充分混合2 h,在压力550MPa 下对混合粉末进行模压,在高温管式炉中将压坯升温至1170℃保温8h 后冷却, 采用粉末冶金方法, 从混合元素粉末中制备一系列新型Ti-Mn-Nb合金, 通过硬度和压缩试验获得的力学性能表明,Ti-7Mn-xNb 合金具有比纯钛金属材料具有更高的硬度以及更低的弹性模量。
采用粉末冶金工艺可制备出性能良好的医用钛合金,也可制备出净成形的合金,大大减少了后期的处理工作,但对制粉要求较高,且烧结温度基本都在高温(>1000℃)下进行,从而增加了反应的能耗。
2、 机械合金化
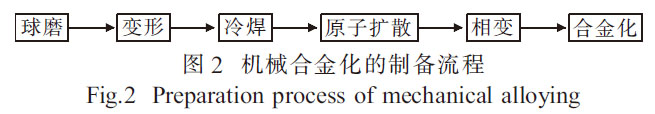
机械合金化(MA)[17-18]广泛用于均匀化和混合元素粉末, 以进一步在固态下利用元素粉末制备合金。其制备流程[19]如图2 所示,可通过快速焊接和断裂在原子水平上将元素粉末混合在一起。在制备磁性、超导等材料中取得了很大进展[20]。随着研究工作的深入, 机械合金化技术将在新材料制备中发挥更大的作用。
钛合金本身一般不具有抗菌性能, 并且由于植入物引起相关的感染而导致术后并发症或植入失败等难题,研究者将无机抗菌剂引入钛合金中,制备了抗菌生物医用合金材料[21]。Li等[22]采用工业纯Ti 粉和Bi 粉经机械合金化和后续的放电等离子烧结技术制备了二元Ti-Bi 合金,Ti-Bi 合金的压缩屈服强度比工业纯Ti (CP-Ti) 合金的高约22%~44%,当
Bi 含量为0.5%时,Ti-Bi 合金具有约1080MPa 的屈服强度以及约2226MPa 的极限抗压强度,断裂应变约34.3%, 在生物医学中表现出优异的塑性及综合力学性能。在钛合金的合金元素中,Mo 是一种很强的β 相稳定剂,能提高钛合金的耐蚀性,从生物学的角度来看,Mo 是许多对细胞代谢重要的酶的必需微量元素[23]。Ag 具有更好的抗菌作用,同时保持了与纯Ti 相似的生物相容性。Zhang等[24]利用具有β 相的稳定元素Mo 和抗菌元素Ag, 以原子比为18∶1∶1 的纯Ti、Mo 和Ag 为起始原料, 采用机械合金化和放电等离子烧结相结合的方法制备了大块细粒Ti-5Mo-5Ag 合金,900℃烧结的合金呈现出89%的β 相基体,平均晶粒尺寸为(8.1±3.2)μm,11%的α 相在晶界/ 三界处有微米/ 亚微米级析出相的网状组织,其屈服强度高达(1694±8.4)MPa,断裂应变为23%。与纯Ti 相比,所制备的Ti-5Mo-5Ag 合金还表现出较强的耐蚀性和优异的抗菌活性。
机械合金化优点是时间短、能耗低、涂层附着力好、形成各种结构涂层的柔韧性好,可很容易地获得所需的化学成分和结构的涂层。
3、增材制造技术
增材制造(AM)技术[25-26],也称为3D 打印技术,以3D 模型将材料连接起来逐层进行数据制备合金的工艺,与减材制备合金技术相反。它涵盖了一系列使用逐层方法来构建零件或产品的技术, 主要有电子束熔炼技术和选择性激光熔化[27],以粉末为原料的AM 技术是制造金属合金材料最常用的方法。
3.1 电子束熔炼技术
电子束熔炼(EBM)技术[28-29]是以电子束为热源,在高温、高真空条件下使用前体金属粉末精确分层制备复杂金属合金结构。根据3D 模型,来自焊枪的电子束由偏转线圈控制并聚焦在金属粉末床上,粉末通过熔化与电子束反应, 然后由两个粉末盒添加另一粉末层, 新粉末通过粉耙均匀地分布在整个表面上,并且该过程以逐层方式继续进行,直到零件达到最终成形[30]。此外,EBM 技术还可加工高熔点或高硬度的金属, 这些显著的优点使得EBM 不仅在工业上,而且在医学领域都具有极大的吸引力,能使植入物准确地适应不同的缺陷位置。
采用多孔结构可以降低钛合金零件与人体骨骼之间的模量差。Chen等[31]以预合金Ti-6Al-4V 粉末为原料, 采用电子束熔化技术制备了具有金刚石晶格韧带结构、孔隙率高达80%的多孔Ti-6Al-4V 泡沫材料,对于所有80%孔隙率的不同韧带宽度和孔径的EBM 泡沫材料, 可以很好匹配人体松质骨的杨氏模量和应力水平, 有效降低应力遮挡效应的风
险。Almanza等[32]以Ti-6Al-4V 合金粉末采用电子束熔炼技术制备了Ti-6Al-4V 合金,降低了0.50~0.14mm/a 的腐蚀速率,可提高长期植入物的抗腐蚀性。
电子束熔炼技术可用于制备难以加工、需要昂贵工具的合金。真空条件为电子束熔炼提供了一个可控的环境,以传统的方式减少了制备合金的缺陷,从而提高了合金的耐腐蚀性等。
3.2 选择性激光熔化
选择性激光熔化(SLM)[33-34]技术是一种分层的成形工艺, 能实现高几何复杂度的合金零件接近净形状生产,它是对传统钛合金零件生产路线(如锻造和铸造)的补充。在SLM 中,在粉末床上铺上一薄层金属合金粉末,并用高功率激光选择性地熔化,这个过程逐层重复,直到制备出整个合金零件[35]。由于SLM 独特的成形工艺,不同的成形方向得到不同的织构成分, 从而使医疗器械或植入物具有不同各向异性的性能。

在生物医学中, 选择性激光熔化制备的最终植入物是通过积累层获得,除了致密的植入物外,SLM还可制造具有格状结构的定制植入物, 从而使新骨组织向内生长并输送体液。Luo等[36]首先通过等离子旋转电极法制备Ti-30Nb-5Ta-3Zr(TNTZ)合金粉末,再采用选择性激光熔化制备了Ti-30Nb-5Ta-3Zr合金,TNTZ 的拉伸强度、杨氏模量、伸长率和疲劳极限分别为~680 MPa,~64.2 GPa,~15.3%和~140MPa。当孔隙率为77.23%(体积) 的晶格结构时,TNTZ 样品屈服强度范围为15.7~520MPa,可用于修复或代替人类皮质骨, 没有细胞毒性, 并且比Ti-6Al-4V 表现出更好的生物相容性,低应力屏蔽趋势和较高的力学性能。增材制造技术可用于制备生物医学应用的开孔金属支架, 与传统的制造工艺相比,具有许多优势。Li等[37]首先使用可消耗电极真空电弧炉熔融法制备出Ti35Zr28Nb 合金锭,再利用等离子体旋转电极雾化系统将合金锭雾化成球形粉末, 最后采用选择性激光熔化制备用于生物医学应用的块状和多孔状新型β-Ti35Zr28Nb 合金支架。得出:①SLM 制备的大块样品在纵向和横向分别显示出57、60GPa 的弹性模量, 以及612、768MPa 的压缩屈服强度;②SLM 制备的孔隙率为83%的支架在纵向和横向上的弹性模量值分别为1.1、0.7GPa,抗压屈服强度值分别为27、8MPa;③SLM 制造的孔隙
率为50%的支架在纵向和横向上的弹性模量值为1.3、1.0 GPa, 抗压屈服强度值分别为58、45MPa,SLM 制备的Ti35Zr28Nb 支架具有良好的腐蚀性能和生物相容性。
选择性激光熔化技术能够使用合金粉末直接制备复杂的网状植入物, 具有可用于生物医学应用中定制植入物结构的特点,然而,也存在着成本高、效率低等缺点。
4、 结语与展望
(1) 钛丝、钛棒等钛合金与纯金属材料相比,具有独特的生物医学应用优势, 已被用作制造骨科假体和牙种植体的结构生物材料中,可改善患者的健康状况,使患者能无痛苦正常生活,延长人类寿命。
(2) 粉末冶金法是制备生物医疗器械的传统方法, 使用预合金或混合元素等不同类型的粉末可扩大不同应用,达到所需要的性能范围;可降低制备成本,将部件制备达到接近净形状,但模压过程中需要的模具成本较高。
(3) 机械合金化能有效降低合金化温度,简化难熔元素合金的制备,通过调节工艺参数,可以很容易地获得均匀、精细、甚至纳米晶的微观结构。因此,通过机械合金化可以制备出化学成分分布均匀、纳米晶体结构的材料, 气体环境也可能会影响合金的性能, 对于制备特殊的合金更需要成本较高的特殊气体作为保护气。
(4) 电子束熔炼法能在不使用传统工具、低制造成本、更快的时间和最少的人为干预的情况下,更精确地获得尺寸可控、几何形状更复杂的产品,可以获得较短的制备周期,省略大量的机械加工,可以降低材料的制备成本和制备产生的废料, 从而降低对环境的影响,但在制备过程中对真空度要求较高。选择性激光熔化能经济高效地制备复杂形状的致密合金,制备步骤少,灵活性好并且材料利用率较高,可直接获得与锻造合金一样的优异力学性能。在真空条件下,气体的体积将大大减小,提高合金材料的质量, 但金属材料的加热和冷却速率也可能会强烈影响最终材料的力学性能与生物相容性。
(5) 提高生物医用钛合金材料与人体的相容性、降低合金材料在使用过程中产生的应力屏蔽效应以及医用钛合金的弹性模量等性能是未来的研究方向, 使新型医用钛合金材料在人体中不产生副反应。采用二种或多种方法结合降低制备成本提高制备效率, 研究出最适合绿色工业化生产生物医用钛合金的工艺。
参考文献:
[1] Oh J M, Park C H, Yeom J T, et al.High strength andductility in low-cost Ti-Al-Fe-Mn alloy exhibitingtransformation-induced plasticity [J]. Materials Science andEngineering A,2020,772:138813-138822.
[2] 周泉, 丁泽良, 王易, 等.Ti6Al4V 钛合金表面Ta2O5/Ta2O5-Ti/Ti 多涂层的制备与性能研究[J]. 包装学报,2019,11(6):23-30.
[3] Yan L, Yu J, Zhong Y,e t al. Influence of scanning on nanocrystalline β-Ti alloys fabricated by selective laser melting andtheir applications in biomedical science [J].Journal ofNanoscience and Nanotechnology,2020,20(3):1605-1612.
[4] Jackson M J, Kopac J, Balazic M, et al. Titanium andtitanium alloy applications in medicine[M].Surgical Tools andMedical Devices:Springer,Cham,2016:475-517.
[5] 张远. 医用纯钛及Ti-6Al-4V 表面微纳结构的制备及生物相容性研究[D].长沙:湖南大学,2018.
[6] Li X P, Ji G, Eder K, et al. Additive manufacturing of anovel alpha titanium alloy from commercially pure titaniumwith minor addition of Mo2C[J].Materialia,2018,4:227-236.
[7] Jia M T, Gabbitas B, Bolzoni L.Evaluation of reactiveinduction sintering as a manufacturing route for blendedelemental Ti-5Al-2.5Fe alloy [J].Journal of MaterialsProcessing Technology,2018,255: 611-620.
[8] Weng W J, Arne B, Li Y C, et al. Effects of selectedmetallic and interstitial elements on the microstructure andmechanical properties of beta titanium alloys for orthopedicapplications[J]. Materialia,2019,6:100323-100332.
[9] Elias C N, Lima J H C, Valiev R, et al.Biomedicalapplications of titanium and its alloys [J]. Jom,2008,60(3):46-49.
[10] Guo W M, Liu B, Liu Y, et al. Microstructures and mechanical properties of ductile NbTaTiV refractory high entropy alloyprepared by powder metallurgy [J].Journal of Alloys andCompounds,2019,776: 428-436.
[11] 魏文庆,曹光明,刘炳强,等.粉末冶金Nb-35Ti-6Al-5Cr-8V合金组织演变及其力学行为[J]. 稀有金属材料与工程,2019,48(12):4106-4112.
[12] Niu H Z, Zhang H R, Sun Q, et al. Breaking through thestrength-ductility trade-off dilemma in powder metallurgyTi-6Al-4V titanium alloy[J].Materials Science and EngineeringA,2019,754:361-369.
[13] Nassar A, Nassar E.Properties of aluminum matrix Nanocomposites prepared by powder metallurgy processing [J].Journal of King Saud University: Engineering Sciences,2017,29(3):295-299.
[14] Li X, Ye S L, Yuan X N, et al. Fabrication of biomedicalTi-24Nb-4Zr-8Sn alloy with high strength and low elasticmodulus by powder metallurgy [J]. Journal of Alloys andCompounds,2019,772: 968-977.
[15] Xu W, Tian J J, Liu Z, et al. Novel porous Ti35Zr28Nbscaffolds fabricated by powder metallurgy with excellentosteointegration ability for bone-tissue engineering applications[J].Materials Science and Engineering C,2019,105:110015-110024.
[16] Ehtemamhaghighi S, Attar H, Dargusch M S, et al.Microstructure,phase composition and mechanical properties ofnew,low cost Ti-Mn-Nb alloys for biomedical applications [J].Journal of Alloys and Compounds,2019,787:570-577.
[17] Jiang J, Shen Y F, Feng X M.Microstructure evolution,formation mechanisms and properties of SiCp/Al compositecoatings on Ti-6Al-4V substrate via mechanical alloying method[J]. Surfaces and Interface,2020,19:100487-100496.
[18] 颜建辉,李凯玲,汪异,等.机械合金化和放电等离子烧结制备NbMoCrTiAl 高熵合金[J]. 材料导报,2019,33 (10):1671-1675.
[19] Suryanarayana C. Mechanical alloying and milling [J].Progress in Materials Science,2001,46(1/2):1-184.
[20] Tian Y, Shen Y, Lu C, et al. Microstructures and oxidationbehavior of Al-CrMnFeCoMoW composite coatings onTi-6Al-4V alloy substrate via high-energy mechanical alloyingmethod [J]. Journal of Alloys and Compounds,2019,779:456-465.
[21] Lei Z M, Zhang H Z, Zhang E L, et al. Antibacterialactivities and biocompatibilities of Ti-Ag alloys prepared byspark plasma sintering and acid etching [J]. Materials Scienceand Engineering C,2018,92:121-131.
[22] Li Z J, Dong A P, Xing H, et al. Microstructure andmechanical properties of bimodal TiBi alloys fabricated bymechanical alloying and spark plasma sintering for biomedicalapplications [J].Materials Characterization,2020,161:110134-110145.
[23] Chen Q Z, Thouas G A.Metallic implant biomaterials [J].Materials Science and Engineering: R: Reports,2015,87(87):1-57.
[24] Zhang Y W, Chu K J, He S, et al.Fabrication of highstrength,antibacterial and biocompatible Ti-5Mo-5Ag alloy formedical and surgical implant applications[J].Materials Scienceand Engineering C,2020,106:110165-110173.
[25] 王祥,张林杰,李森,等.增材制造Ti-6Al-4V 组织的演化与拉伸性能的差异[J].航空制造技术,2019,62(17):88-94.
[26] Neikter M, 魡kerfeldt P, Pederson R, et al. Microstructuralcharacterization and comparison of Ti-6Al-4V manufacturedwith different additive manufacturing processes [J].MaterialsCharacterization,2018,143:68-75.
[27] Fojt J, Fousova M, Jablonska E, et al.Corrosion behaviourand cell interaction of Ti-6Al-4V alloy prepared by two techniquesof 3D printing [J].Materials Science and EngineeringC,2018,93:911-920.
[28] Hara D, Nakashima Y, Sato T, et al.Bone bonding strengthof diamond-structured porous titanium-alloy implants manufacturedusing the electron beam-melting technique [J]. MaterialsScience and Engineering C,2016,59:1047-1052.
[29] 李建兵,马治龙,王强,等.电子束法生产金属钒用钒铝合金制备工艺的研究[J].湖南有色金属,2019,35(4):39-42.
[30] Fiaz H S, Settle C R, Hoshino K.Metal additivemanufacturing for microelectromechanical systems:titaniumalloy (Ti-6Al-4V)-based nanopositioning flexure fabricated byelectron beam melting [J].Sensors and Actuators A: Physical,2016,249:284-293.
[31] Chen S Y, Kuo C N, Su Y L, et al. Microstructure andfracture properties of open-cell porous Ti-6Al-4V with highporosity fabricated by electron beam melting [J]. MaterialsCharacterization,2018,138:255-262.
[32] Almanza E, Pérez M J, Rodríguez N A, et al.Corrosionresistance of Ti-6Al-4V and ASTM F75 alloys processed byelectron beam melting [J].Journal of Materials Research andTechnology,2017,6(3):251-257.
[33] Jiang X J, Chen G Y, Men X L, et al. Grain refinement andexcellent mechanical properties of a Ti-based alloy via lasermelting and subsequent low temperature annealing[J]. MaterialsScience and Engineering A,2018,737:182-187.
[34] 彭丹华,张正文,张凯飞,等.选择性激光熔化成形Ti6Al4V钛合金的滚动接触疲劳性能研究[J].机械强度,2019,41(1):60-65.
[35] Moridi A, Demir A G, Caprio L, et al. Deformation andfailure mechanisms of Ti-6Al-4V as built by selective lasermelting [J]. Materials Science and Engineering A,2019,768:138456-138465.
[36] Luo J P, Sun J X, Huang Y F, et al. Low-modulusbiomedical Ti-30Nb-5Ta-3Zr additively manufactured bySelective Laser Melting and its biocompatibility [J].MaterialsScience and Engineering C,2019,97: 275-284.
[37] Li Y C, Ding Y F, Munir K S, et al. Novel β-Ti35Zr28Nballoy scaffolds manufactured using selective laser melting forbone implant applications [J].Acta biomaterialia,2019,87:273-284.
相关链接







